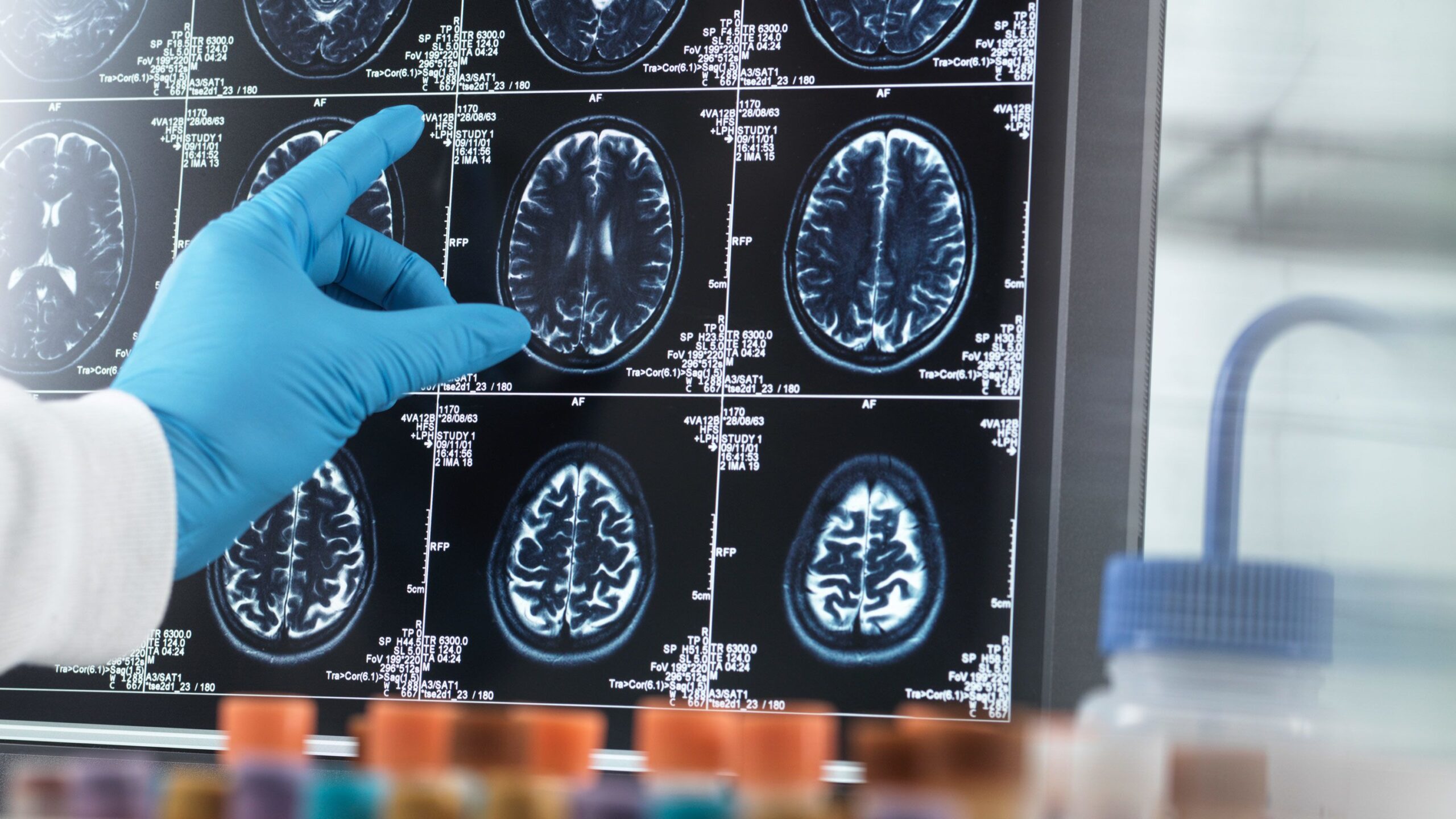
6月9日(周五),美国食品和药物管理局(FDA)的一个独立顾问小组一致通过了卫材(Eisai)和百健(Biogen)生产的治疗阿尔茨海默病的药物Leqembi,为今年夏天全面批准这种药物铺平了道路。顾问们以6比0的投票结果认为,卫材的数据证明了对患者的临床有益处。美国食品和药物管理局不需要遵循顾问的建议,但专家组对Leqembi的投票将对完全批准产生重大影响。
美国食品和药物管理局预计将于7月6日对Leqembi做出最终决定。该机构的决定将决定Medicare是否广泛覆盖治疗。这项针对老年人的计划目前严重限制了Leqembi的覆盖范围,因为它之前是通过快速程序获得批准的。卫材将Leqembi的年度定价定为每年2.65万美元,这意味着如果没有医疗保险,大多数患者都负担不起这种治疗。6月9日(周五)Leqembi的咨询委员会非常小,只有六名有投票权的成员。美国食品和药物管理局神经科学办公室代理主任特蕾莎·布拉奇奥(Teresa Buracchio)博士说,委员会的规模比以往要小,是因为一些专家由于利益冲突而回避了该会议。布拉奇奥说:“虽然这个小组很小,但它包含了对今天的问题进行强有力讨论所必需的适当专业知识。”
Leqembi是卫材和百健公司推出的第二款接受美国食品和药物管理局审查的阿尔茨海默病治疗药物,此前药物Aduhelm在2021年夏天获得了有争议的批准。尽管11名咨询委员会成员中有10人认为该药物没有显示出临床益处,但药品监管机构还是加速批准了这两家公司开发的Aduhelm。随后国会调查发现,对Aduhelm的批准“充满了违规行为”。参议院卫生委员会主席伯尼·桑德斯(Bernie Sanders)参议员6月7日(周三)在一封信中告诉卫生与公众服务部,“美国食品和药物管理局在审查先前的阿尔茨海默病药物Aduhelm期间与百健发生了不适当的关系,因此有责任恢复公众的信任。”
卫材对Leqembi的研究发现,这种药物使早期阿尔茨海默病患者的认知能力下降速度减缓了27%。这种抗体每月两次通过静脉输注给药。它的目标是一种叫做淀粉样蛋白的蛋白质,通常被称为斑块,这种蛋白质在大脑中积聚并与疾病有关。布拉奇奥告诉专家组,该机构认为这些结果对患者具有临床意义。几个有亲人被诊断出患有阿尔茨海默病的家庭在公众评论部分告诉专家组,Leqembi给他们带来了希望。
但Leqembi也有严重的脑肿胀和出血风险。在研究期间,13%接受Leqembi治疗的患者出现肿胀,14%出现出血。根据美国食品和药物管理局的说法,肿胀和出血通常是轻微的,没有明显的症状,但这些发作可能危及生命。研究中有三人死亡可能与Leqembi有关,尽管美国食品和药物管理局在审查中无法得出明确的结论。两名患者在接受注射后死于脑出血。他们服用了血液稀释剂。第三名死亡的患者患有一种叫做脑淀粉样血管病的潜在疾病,其中大脑中的血管较弱,可导致出血。美国食品和药物管理局官员德尼兹·埃尔滕-莱昂斯(Deniz Erten-Lyons)博士告诉专家组,在Leqembi治疗期间服用血液稀释剂可能会增加脑出血的风险。
在6月7日(周三)会议的公众评论部分,几个团体对美国食品和药物管理局批准Leqembi表示强烈反对。公众健康研究组织(Public Citizen’s Health Research Group)的尼娜·泽尔德斯(Nina Zeldes)说,美国食品和药物管理局还没有收到明确有力的证据,证明Leqembi具有临床疗效。泽尔德斯说,根据目前的数据,与治疗相关的严重安全问题超过了益处。美国医生协会(Doctors for America)的神经学家唐娜·金·墨菲(Dona Kim Murphy)博士说,卫材的研究存在缺陷,因为患阿尔茨海默病风险较高的美国黑人在试验中的代表性严重不足。在试验期间接受Leqembi治疗的参与者中,美国黑人占2.3%。
Leqembi在1月份获得快速审批后,在技术上已经在美国市场上市,但很少有老年人能够获得这种昂贵的治疗,因为Medicare将保险范围限制在只有参加临床试验的人。目前还没有进行临床试验。因此,大多数老年人只有在有能力自掏腰包购买药物的情况下才能使用Leqembi。Medicare承诺在美国食品和药物管理局完全批准Leqembi的同一天,将广泛覆盖该药物。退伍军人健康管理局已经覆盖了退伍军人的治疗。
未经允许不得转载:城市新闻网icitynews » FDA:阿尔茨海默病药物Leqembi或可获得全面批准






































